出国留学网专题频道知识点栏目,提供与知识点相关的所有资讯,希望我们所做的能让您感到满意!
03-18
如何才能轻松写好范文呢?很多时候我们都要掌握文头的书写,范文就可以潜移默化的改变我们的思想,出国留学网的编辑经过搜集和处理,为你提供初中中考化学知识点总结。
我们周围的空气
1、第一个对空气组成进行探究的化学家:拉瓦锡(第一个用天平进行定量分析)。
2、空气的成分和组成
(1)空气中氧气含量的测定
a、可燃物要求:足量且产物是固体:选择红磷
b、装置要求:气密性良好
c、现象:有大量白烟产生,广口瓶内液面上升约1/5体积
d、结论:空气是混合物; O2约占1/5,可支持燃烧;
N2约占4/5,不支持燃烧,也不能燃烧,难溶于水
e、探究:①液面上升小于1/5原因:装置漏气,红磷量不足,未冷却完全就打开弹簧夹。
②能否用铁、铝代替红磷?不能原因:铁、铝不能在空气中燃烧
能否用碳、硫代替红磷?不能原因:产物是气体,不能产生压强差
(2)空气的污染及防治:对空气造成污染的主要是有害气体(CO、SO2、氮的氧化物)和烟尘等。目前计入空气污染指数的项目为CO、SO2、NO2、O3和可吸入颗粒物等。
(3)空气污染的危害、保护:
危害:严重损害人体健康,影响作物生长,破坏生态平衡.全球气候变暖,臭氧层破坏和酸雨等
保护:加强大气质量监测,改善环境状况,使用清洁能源,工厂的废气经处理过后才能排放,积极植树、造林、种草等
(4)目前环境污染问题:
臭氧层破坏(氟里昂、氮的氧化物等) 温室效应(CO2、CH4等)
酸雨(NO2、SO2等) 白色污染(塑料垃圾等)
6.氧气
(1)氧气的.化学性质:特有的性质:支持燃烧,供给呼吸
(2)氧气与下列物质反应现象
铁、铝燃烧要在集气瓶底部放少量水或细砂的目的:防止溅落的高温熔化物炸裂瓶底
铁、铝在空气中不可燃烧。
(3)氧气的制备:
工业制氧气——分离液态空气法(原理:氮气和氧气的沸点不同 物理变化)
实验室制氧气原理 2H2O2 MnO2 2H2O + O2↑
2KMnO4 △ K2MnO4 + MnO2 + O2↑
2KClO3MnO22KCl+3O2↑
(4)气体制取与收集装置的选择 △
发生装置:固固加热型、固液不加热型 收集装置:根据物质的密度、溶解性
1.酸的五条通性:
(1)酸与指示剂反应,遇紫色石蕊变红
(2)酸与某些金属反应,生成盐和氢气
(3)酸与某些金属氧化物反应,生成盐和水
(4)酸与碱反应生成盐和水
(5)酸与盐反应生成新盐和新酸
2.碱的四条通性:
(1)碱【溶液】与指示剂反应,遇紫色石蕊变蓝,无色酚酞变红
(2)【可溶性】碱与某些非金属氧化物反应,生成盐和水
...
英国留学的含金量都是很高的,今天出国留学小编就给大家介绍英国海外留学生活知识点汇总,有哪些大学是最值得去留学的?建议收藏~如果对这个话题感兴趣的话,欢迎点击出国留学网。
越来越多的学生到英国留学,很多学生对即将开始的新生活充满期待,但又担心不能适应英国留学生活,那么,英国留学生活到底是怎样的呢?接下来跟随华通国际一起了解一下。
1、学术方面
英国主要的授课方式有三种,分别为:Lecture模式、Seminar模式以及Tutorial模式。
Lecture模式主要是集中授课,跟常见的国内大学上课方式比较相似,一般教授会在讲台上用PPT为学生们讲解知识点,偶尔会和学生交流互动,主要是“教 为主。
Seminar模式就是小型研讨会,学生以小组为单位,在一起进行探讨,每个Seminar都有一名导师和助教,相对来讲互动性非常强。
Tutorial模式就是辅导课,针对性非常强,每个学生都会分配一名导师,导师和学生进行1V1沟通。导师不光会在学业上答疑解惑,也会从生活上给予帮助和一些心理疏导。
2、实践方面
国外教育和国内教育最大的区别就在于注重实践,能够代表学生实践成果的就是毕业论文。
英国审查论文的角度比国内更为严苛,从文献素材到数据分析,到撰写成文都需要学生自己来完成。学生只有深入钻研才能写出获得导师认可的论文。
在英国有不少知名企业与大学建立了合作项目,留学党们可要抓住能够实践的机会,对于升学和就业都有很大帮助。
3、住宿方面
(1)院校宿舍
院校通常会优先安排国际学生入学时住宿舍。院校宿舍一般都是伙食自理。宿舍基本都是公寓式的,有多间卧室,每室一人自带卫生间、公用厨房等设施。费用在80镑到130镑之间,包含网路、水、电、煤气费用。
(2)住英国人家
一般是留学生租占房东家的一间卧室,一同生活。这应该是英国留学租房中比较贵的一种形式了。费用一般在120镑-150镑之间。
(3)自己租房
留学生还可以和好友一起合租房屋。学生事先可以和院校的国际学生办公室联系,索要房源清单。留学生还可以和好友一起合租房屋。一般来说,有4个房间,1个厨房,2到3个卫生间及前后花园。这是比较省钱的一个途径,所有的费用由合租人共同承担,每人平均一个月200镑。
4、交通方面
英国的交通不便宜。公交车平均价格1镑,但是学生可以办优惠的季度月票,一个季度80镑左右。出租车票价很贵,大车距离不远的话,10到15镑很正常。但是对于那些住在院校宿舍的学生来说,就可以省了交通费用。
5、融入社区生活
外国学生会发现加入所在学校的外国学生社团非常有益。这些社团分为两种类型,一种是不分国籍,面向所有学生的社团,另一种是由来自同一国家的学生组成的...
03-02
各位考生注意了!距离一建机电补考只剩下23天的时间了,请各位考生抓紧时间复习。下面是出国留学网收集整理的 “2023年一建管理与实务科目知识点速记” ,欢迎广大考生前来参考学习本文章,出国留学网在这里提前祝大家考试顺利。
距离一建机电补考只剩下23天的时间了,小编在这里不建议大家迷迷糊糊的去一味地刷题,只寄希望于刷题是不可取的,我们要形成一个完整的系统的知识体系。其实考试讲究的是一个方法,形成完整的思维闭环,要比我们一味刷题来的直接且高效。
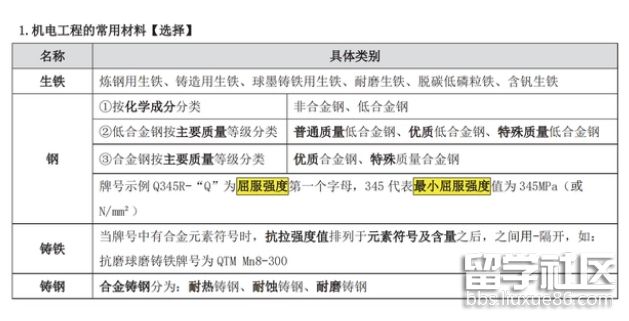

这200个知识速记分门别类的对每一种机电工程的常用材料都进行了清晰的解释,表格形式也能更清晰地进行知识梳理。只要掌握了完整的知识体系,无论考场上试题多么变换,都能轻松应对不再恐惧。平时备考也能做到事半功倍。

02-28
还在为化学难学而苦恼吗,还在为找不到试卷刷题而难受吗,不要担心。小编特地整理出了 “中考必备化学基础知识点汇总” 来供大家参考学习,希望能帮助到大家。愿各位同学都能考出好的成绩,加油!本文仅供参考,欢迎大家的阅读。
一、易混淆知识小结
1.烟:固体小颗粒。 雾:小液滴。
烟雾:既有小颗粒又有小液滴。
2.生石灰:氧化钙CaO 熟石灰(消石灰):氢氧化钙Ca(OH) 2
3.化学式:用元素符号表示物质组成的式子。(表示物质)
化学方程式:用化学式表示化学反应的式子。(表示一个具体的化学反应)
4.构成原子的三种微粒:质子、中子、电子;构成物质的三种微粒:分子、原子、离子。
二、化学符号表示的意义
1.元素符号
(1)表示某种元素;(2)表示这种元素的一个原子;(3)稀有气体元素和金属元素符号还可表示物质。
例:“H”表示:(1)氢元素;(2)一个氢原子;
例:He表示:氦气
注:元素符号前带上数字只表示原子的个数。例“2H”只表示2个氢原子。
表示:(1)反应物是氢气和氧气,在点燃条件下生成水;
(2)每4份质量的氢气和32份质量的氧气反应能生成36份质量的水。
2.离子符号的意义
带电的原子或原子团叫离子(在元素符号或原子团右上角标注带电荷数)。
表示一个什么离子,离子符号前面带上数字表示几个什么离子。
例:Fe 3 表示一个铁离子 2Fe 3 表示2个铁离子
Fe 2 表示一个亚铁离子 2Fe 2 表示2个亚铁离子
SO 4 2- 表示一个硫酸根离子 2NO 3 - 表示2个硝酸根离子
3.化学用语中数字的意义
(1)元素符号前的数字表示某原子的个数。如:3C表示3个碳原子。
(2)化学式中数字表示的意义:
A.前面的数字表示分子个数。 如:2CO2中前“2”表示2个二氧化碳分子。
B.化学式中足码表示一个某分子中含有该原子的个数。
如:2CO 2 中足码“2”表示1个二氧化碳分子中含有2个氧原子。
(3)离子符号中数字的意义:
A.前面的数字表示离子的个数。
如“2Fe 3 ”中2表示2个铁离子。
B.离子符号右上角数字表示一个该离子带正(负)电荷数。 如“2Fe 3 ”中3表示一个铁离子带3个单位的正电荷。
(4)化合价标注的意义:
化合价在元素或原子团正上方标注。表示某元素或原子团的化合价是多少。
表示铁元素的化合价是 3价
表示氧元素的化合价是-2价
表示硫酸...
很多考生在复习中考化学时,因为没有掌握重要的知识要点,导致复习时整体效率不高。下面是由出国留学网为各位考生收集整理的“中考化学必考的六大类重要知识点汇总”,欢迎各位考生参考阅读。祝大家都能取得好的成绩。
一、初中化学常见物质的颜色
(一)固体的颜色
1、红色固体:铜,氧化铁
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾
5、淡黄色固体:硫磺
6、无色固体:冰,干冰,金刚石
7、银白色固体:银,铁,镁,铝,汞等金属
8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
(二)液体的颜色
11、无色液体:水,双氧水
12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液
13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液
14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液
15、紫红色溶液:高锰酸钾溶液
16、紫色溶液:石蕊溶液
(三)气体的颜色
17、红棕色气体:二氧化氮
18、黄绿色气体:氯气
19、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体。
二、初中化学溶液的酸碱性
1、显酸性的溶液:酸溶液和某些盐溶液(硫酸氢钠、硫酸氢钾等)
2、显碱性的溶液:碱溶液和某些盐溶液(碳酸钠、碳酸氢钠等)
3、显中性的溶液:水和大多数的盐溶液
(一)质量增加的
1、由于吸水而增加的:氢氧化钠固体...
历史是大家了解从古至今的文化和重大事件的启蒙,也是中考必考的一门重要科目。下面是出国留学网为各位考生收集整理的 “2022年中考历史知识点” ,供大家参考学习,希望能够帮到大家。最后祝所有考生能在中考取得自己满意的成绩。
一、中国古代史
1.老子是道家学派的创始人儒家思想得到继承与发扬,因为在这一时期还吸取了法家、道家、阴阳家等各家思想。
3.秦国商鞅变法废除分封制,确立的是县制,秦始皇确立郡县制 。
4.不能说甲骨文是我国最早的文字,只能说是目前已知的最早的汉字。
5. 科举制度正式形成于隋炀帝时期,不是隋文帝时期。
6.佛教没有被阿拉伯人传至欧洲,佛教传入中国是在西汉末年。
7.明朝流行于苏州昆山一带的是昆曲,不是京剧,成为了一个全国性的剧种。
二、中国近代史
1.最先破坏中国关税自主权的条约是《南京条约》。八国联军侵华的主要目的是镇压义和团运动,根本目的是维护和扩大在华利益。
2.在19世纪中期,中日两国曾经有过“同病相怜”的相同命运。1850年一部中国人编写的系统介绍世界各地历史地理的著作传入日本,日本有识之士争相传阅,奉为海防宝鉴的著作是魏源的《海国图志》。
3.戊戌变法和辛亥革命的相同点是:爱国的进步的运动,经济上要求
2023年高考马上就要到来了,小编相信很多的同学都是非常的关心高考英语有哪些必考的知识点的,下面是小编收集整理的 “高考英语必考知识点”,供各位考生参考学习,希望能帮助到大家。最后祝各位考生考试顺利。
1.名词的单复数
规则变化+s/es、不规则变化(mouse-mice)、单复数同形、同一词在不同意义下有可能可数有可能不可数
2.名词所有格
‘s(表示有生命:Lily’s desk)、of所有格(表示无生命the window of the room)
3.名词修饰语
只修饰可数名词(each、every、a great many)、只修饰不可数名词(little、a little、 alarge amount of)、都可以修饰(some、alot of、plenty of)
4.不定冠词(a/an单数不特指);定冠词(the/this/that/these/those表特定)
5.such的用法
such作限定词和all,no,any,some,other,anther等词连用时,such放后面。
如果such修饰单数可数名词,且与不定冠词连用时需置于其前;such前有no时不用冠词。
6.so的用法
在believe,think,expect,suppose等词后用so代替前文提出的观点
在肯定句中表示与上文相同的情况,如:So do I.
7.all和both的用法
all三者或三者以上全部都,both二者都。all指整体或抽象事物时当做单数,指人时当做复数。both做主语时,谓语动词用复数。
8.many修饰或替代可数名词,much修饰或替代不可数名词
many a 许多(谓语动词用单数)
a good/greatmany很多
as many as/asmuch as一样多、差不多
9.little几乎没有,修饰不可数名词
a little有一点,修饰不可数名词
few几乎没有,修饰可数名词
a few有一点,修饰可数名词
10.形容词比较级最高级
原级比较:…is as good asmine.
表示少于或超过另一方:fewer than, morethan
易混淆短语:as well as也…既…
as far as就…而言
11.比较级常见错误:
用much表强调时的误用
She looks more younger than I.(×)
She looks much younger than I.(√)
12.介词短语重点
except for除了
in place of代替
on behalf of代表
but for要不是
in front of在…前面
13.介词across, over, through, ...
2023年高考即将来临,各位考生是不是还在为找不到合适的全面的复试资料而烦恼?今天小编就给大家带来了一些有关文综的复习资料,希望能够帮到大家。下面是小编收集整理的 “高考文综必考知识点总结” ,供各位文综考生参考学习。最后祝各位考生考试顺利。
1.坚持两点论和重点论的统一
(1)主要矛盾与次要矛盾。
①含义和地位。
A.主要矛盾:在事物发展过程中处于支配地位、对事物发展起决定作用的矛盾。
B.次要矛盾:在事物发展过程中处于从属地位、对事物发展不起决定作用的矛盾。
②辩证关系:二者相互依赖、相互影响,并在一定条件下相互转化。
③方法论:既要抓重点,集中力量解决主要矛盾;又要统筹兼顾,恰当地处理次要矛盾。
(2)矛盾的主要方面和次要方面。
①含义和地位。
A.矛盾的主要方面:在矛盾的两个方面中处于支配地位,起着主导作用的一方。
B.矛盾的次要方面:在矛盾的两个方面中处于被支配地位,不起主导作用的一方。
②辩证关系:二者既相互排斥,又相互依赖,并在一定条件下相互转化;事物的性质主要是由主要矛盾的主要方面决定的。
③方法论意义:既要一分为二、全面地看问题,又要分清主流与支流,把握主流。
(3)坚持两点论和重点论相统一的认识方法。
①坚持两点论,就是在认识复杂事物的发展过程时,既要看到主要矛盾,又要看到次要矛盾;在认识某一矛盾时,既要看到矛盾的主要方面,又要看到矛盾的次要方面。
②坚持重点论,就是在认识复杂事物的发展过程时,要着重把握主要矛盾;在认识某一矛盾时要着重把握矛盾的主要方面,要抓住主流。
③两点是有重点的两点,重点是两点中的重点。坚持两点论与重点论相结合的方法,反对形而上学的一点论和均衡论。
2.坚持对具体问题作具体分析
(1)是什么。
具体问题具体分析是指在矛盾普遍性原理的'指导下,具体分析矛盾的特殊性,并找出解决矛盾的正确方法。
(2)为什么。
①矛盾特殊性原理的要求。
②具体问题具体分析是马克思主义的一个重要原则,是马克思主义的活的灵魂。
③具体问题具体分析是我们正确认识事物的基础,是我们正确解决矛盾的关键。
(3)怎么办。
①承认矛盾的普遍性,分析矛盾,认识矛盾。
②具体分析矛盾的特殊性,对不同事物的矛盾作具体分析,对同一事物的不同阶段的特...
总结是对某一特定时间段内的学习和工作生活等表现情况加以回顾和分析的一种书面材料,它可以帮助我们有寻找学习和工作中的规律。下面是出国留学网收集整理的 “高考数学必考知识点总结” ,欢迎各位考生参考阅读。最后祝各位考生高考顺利。
高考数学必考知识点
1、圆柱体:
表面积:2πRr+2πRh体积:πR2h(R为圆柱体上下底圆半径,h为圆柱体高)
2、圆锥体:
表面积:πR2+πR[(h2+R2)的平方根]体积:πR2h/3(r为圆锥体低圆半径,h为其高,
3、正方体
a-边长,S=6a2,V=a3
4、长方体
a-长,b-宽,c-高S=2(ab+ac+bc)V=abc
5、棱柱
S-底面积h-高V=Sh
6、棱锥
S-底面积h-高V=Sh/3
7、棱台
S1和S2-上、下底面积h-高V=h[S1+S2+(S1S2)^1/2]/3
8、拟柱体
S1-上底面积,S2-下底面积,S0-中截面积
h-高,V=h(S1+S2+4S0)/6
9、圆柱
r-底半径,h-高,C—底面周长
S底—底面积,S侧—侧面积,S表—表面积C=2πr
S底=πr2,S侧=Ch,S表=Ch+2S底,V=S底h=πr2h
10、空心圆柱
R-外圆半径,r-内圆半径h-高V=πh(R^2-r^2)
11、直圆锥
r-底半径h-高V=πr^2h/3
12、圆台
r-上底半径,R-下底半径,h-高V=πh(R2+Rr+r2)/3
13、球
r-半径d-直径V=4/3πr^3=πd^3/6
14、球缺
h-球缺高,r-球半径,a-球缺底半径V=πh(3a2+h2)/6=πh2(3r-h)/3
15、球台
r1和r2-球台上、下底半径h-高V=πh[3(r12+r22)+h2]/6
16、圆环体
R-环体半径D-环体直径r-环体截面半径d-环体截面直径
V=2π2Rr2=π2Dd2/4
17、桶状体
D-桶腹直径d-桶底直径h-桶高
V=πh(2D2+d2)/12,(母线是圆弧形,圆心是桶的中心)
V=πh(2D2+Dd+3d2/4)/15(母线是抛物线形)
高考数学必考公式知识点
1.适用条件:[直线过焦点],必有ecosA=(x-1)/(x+1),其中A为直线与焦点所在轴夹角,是锐角。
x为分离比,必须大于1。注上述公式适合一切圆锥曲线。如果焦点内分(指的是焦点在所截线段上),用该公式;如果外分(焦点在所截线段延长线上),右边为(x+1)/(x-1),其他不变。
2.函数的周期性问题(记忆三个):
...
02-28
高考即将来临,为大家准备了一些化学知识点。希望对大家有所帮助。已经整理好放在下文了,需要的考生快来看看吧!下面是出国留学网整理的“高考化学知识点总结大全”,供考生参考阅读,希望大家都能取得好成绩。
一、氧化还原相关概念和应用
(1)借用熟悉的H2还原CuO来认识5对相应概念。
(2)氧化性、还原性的相互比较。
(3)氧化还原方程式的书写及配平。
(4)同种元素变价的氧化还原反应(歧化、归中反应)。
(5)一些特殊价态的微粒如H、Cu、Cl、Fe、S2O32–的氧化还原反应。
(6)电化学中的氧化还原反应。
二、物质结构、元素周期表的认识
(1)主族元素的阴离子、阳离子、核外电子排布。
(2)同周期、同主族原子的半径大小比较。
(3)电子式的正确书写、化学键的形成过程、化学键、分子结构和晶体结构。
(4)能画出短周期元素周期表的草表,理解“位—构—性”。
三、熟悉阿伏加德罗常数NA常考查的微粒数止中固体、得失电子、中子数等内容。
四、热化学方程式的正确表达(状态、计量数、能量关系)。
五、离子的鉴别、离子共存
(1)离子因结合生成沉淀、气体、难电离的弱电解质面不能大量共存。
(2)因相互发生氧化还原而不能大量共存。
(3)因双水解、生成络合物而不能大量共存。
(4)弱酸的酸式酸根离子不能与强酸、强碱大量共存。
(5)题设中的其它条件:“酸碱性、颜色”等。
六、溶液浓度、离子浓度的比较及计算
(1)善用微粒的守恒判断(电荷守衡、物料守衡、质子守衡)。
(2)电荷守恒中的多价态离子处理。
七、pH值的计算
(1)遵循定义(公式)规范自己的计算过程。
(2)理清题设所问的是“离子”还是“溶液”的浓度。
(3)酸过量或碱过量时pH的计算(酸时以H+浓度计算,碱时以OH–计算再换算)。
八、化学反应速率、化学平衡
(1)能计算反应速率、理解各物质计量数与反应速率的关系。
(2)理顺“反应速率”的“改变”与“平衡移动”的“辩证关系”。
(3)遵循反应方程式规范自己的“化学平衡”相关计算过程。
(4)利用等效平衡”观点来解题。
九、电化学
(1)能正确表明“原电池、电解池、电镀池”及变形装置的电极位置。
(2)能写出各电极的电极反应方程式。
(3)了解常见离子的电...
知识点推荐访问