出国留学网专题频道高考化学试题栏目,提供与高考化学试题相关的所有资讯,希望我们所做的能让您感到满意!
各位浙江省的高考考生注意了!距离2023年高考仅剩下一个月的时间了,为此本网在这里整理了一套2022年的高考化学试卷,希望本套试卷能够帮助到各位考生。下面是出国留学网收集整理的 “浙江省2022年化学高考试题” ,本文供各位考生参考,欢迎阅读。


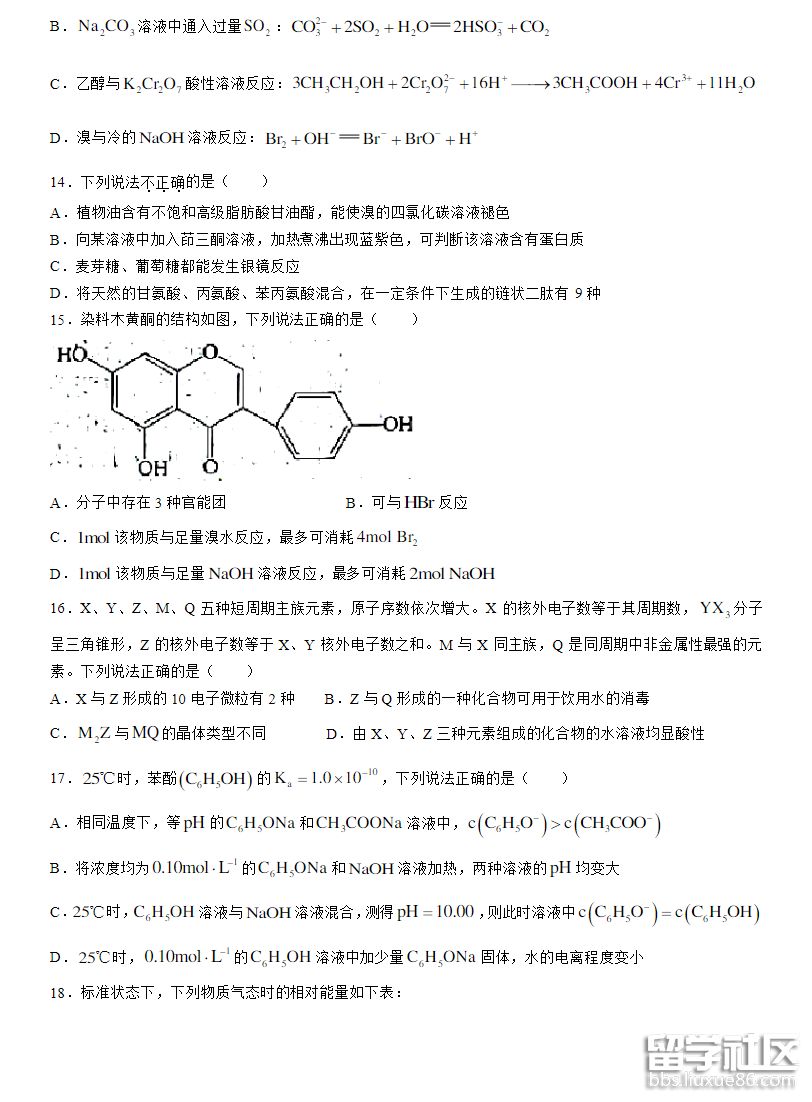



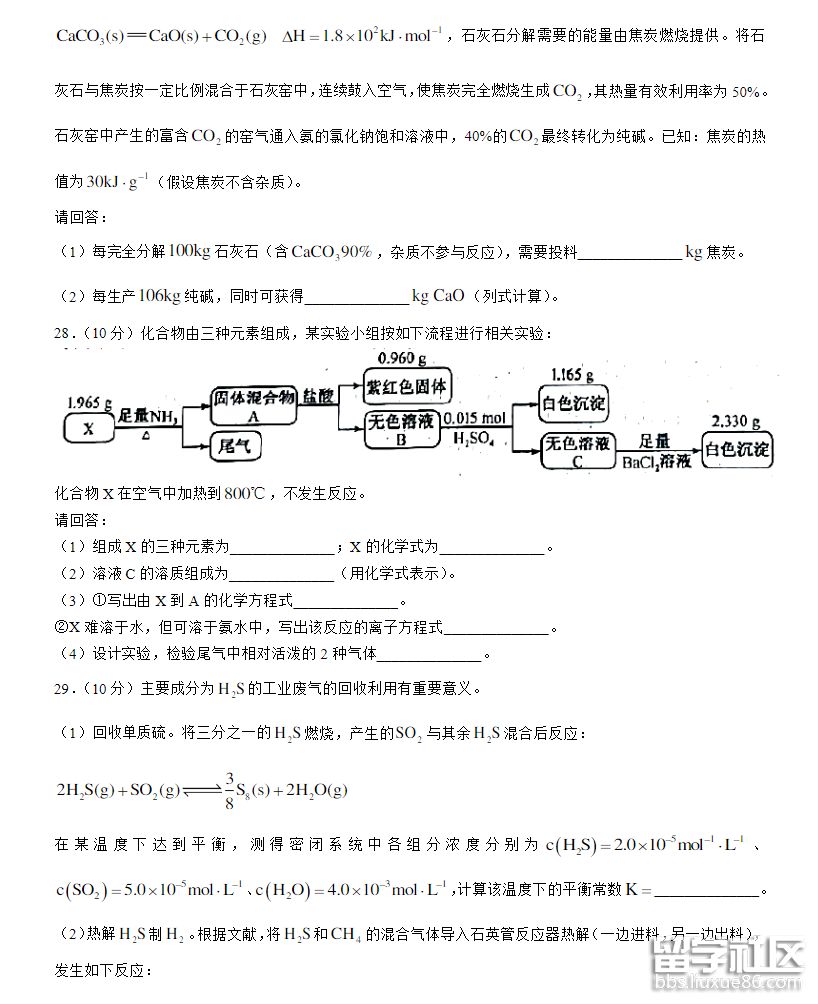


06-11
2022年普通高考理科综合科目考试已经结束了,让我们一起来看看今年高考全国甲卷的化学试题吧!下面是由出国留学网编辑为大家整理的“2022年高考化学试题及答案全国甲卷”,仅供参考,欢迎大家阅读本文。

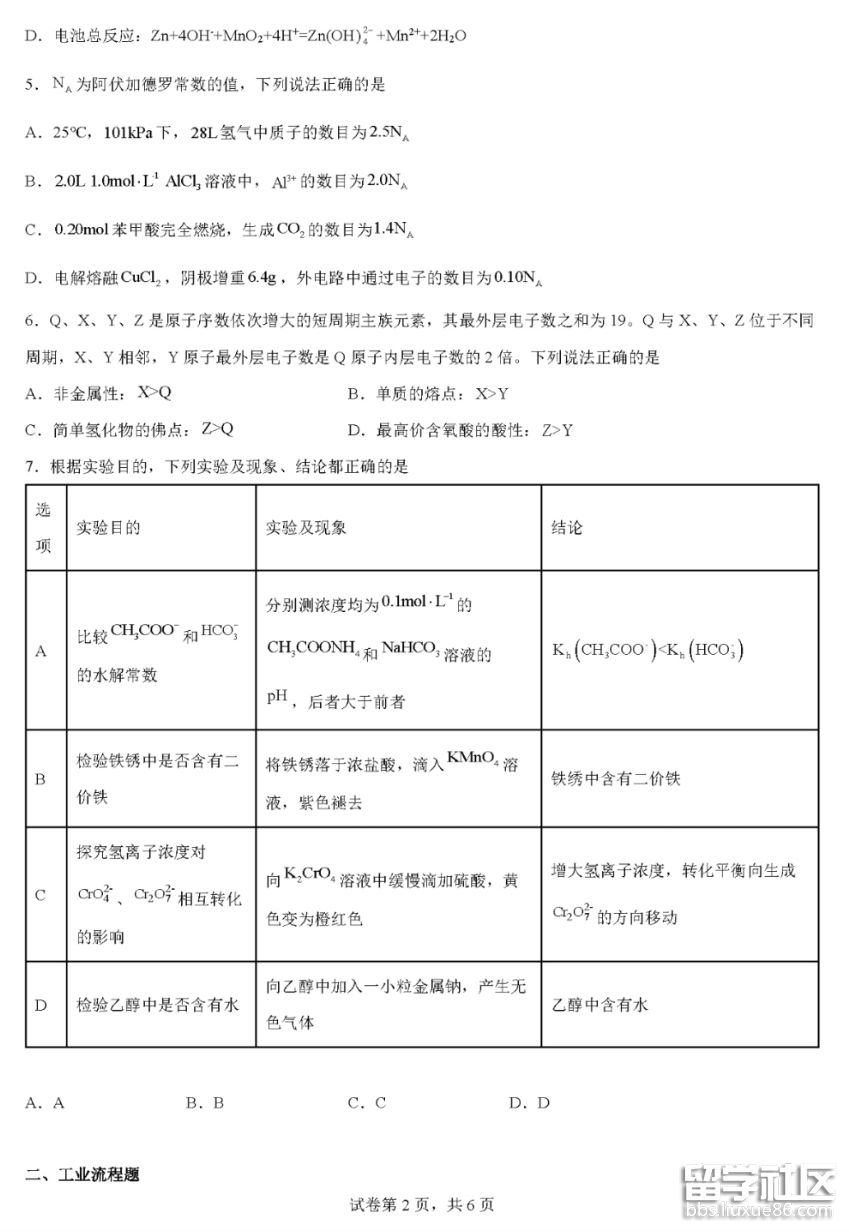


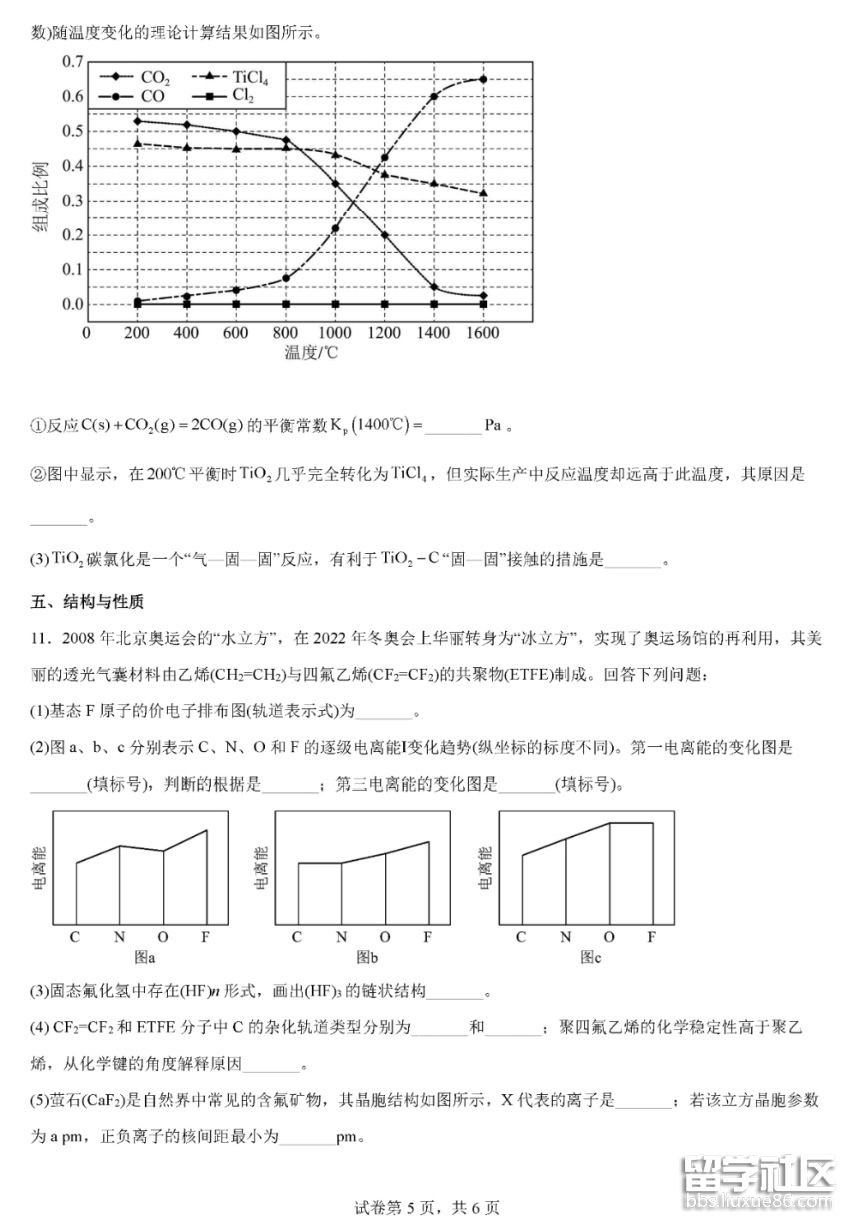
02-21
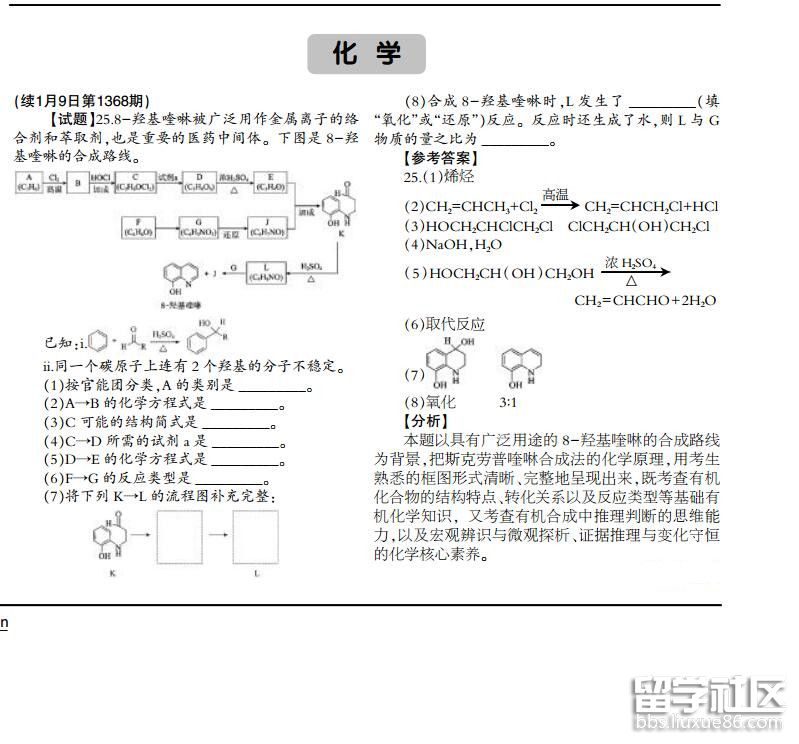
要想学好一门功课,离不开做练习题!小编为大家提供2018年北京高考化学试题及答案解析:25题,赶紧动手练习一下吧!祝大家备考顺利!
2018年北京高考化学试题及答案解析:25题
小编精心为您推荐:
02-10
你的考试准备的怎么样了?考试栏目组小编为你提供了2019年高考化学知识考点试题:化学能与热能,一起来试试吧,想知道更多相关资讯,请关注网站更新。
2019年高考化学知识考点试题:化学能与热能
选择题
1.下列对化学反应的认识错误的是( )。
A.会引起化学键的变化
B.会产生新的物质
C.必然引起物质状态的变化
D.必然伴随着能量的变化
2.“即食即热型快餐”适合外出时使用,其内层是用铝箔包裹已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线使这两种化学物质发生反应,放出的热量便可对食物进行加热,这两包化学物质最适合的选择是( )。
A.浓硫酸和水 B.生石灰和水
C.熟石灰和水 D.氯化钠和水
3.对放热反应:A+B===C+D,以下说法一定正确的是(EA、EB、EC、ED分别表示物质A、B、C、D所具有的能量)( )。
A.EA>EB
B.EA>EB+EC
C.EA+EB>EC+ED
D.EA+EB
4.下列说法不正确的是( )。
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.中和反应都是放热反应
C.已知金刚石在一定条件下转化成石墨是放热的 ,所以金刚石比石墨稳定
D.生石灰放入水中会显著放热
5.下列反应中,生成物的总能量高于反应物的总能量的是( )。
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.②④
6.已知反应:X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是( )。
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
7.已知化学能与其他形式的能量可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是( )。
A.CH4+2O2点燃(=====)CO2+2H2O
B.CaCO3高温(=====)CaO+CO2↑
C.2H2O电解(=====)2H2↑ +O2↑
D.Pb+PbO2+2H2SO4放电充电2PbSO4+2H2O
8.对于反应中的能量变化,表述正确的是( )。
A.放热反应中,反应物的总能量大于生成物的总能量
B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应
D.氧化反应均为吸热反应
9.下列反应属于吸热反应的是( )。
A.氢气还原氧化铜
B.氢气在氧气中燃烧
C.氢氧化钾和硫酸中和
D.碳酸...
距离高考还有5个月左右的时间,你准备好了吗?小编为你精心准备了2019年高考化学知识考点:元素周期表和元素周期律的应用,希望能帮助到你哦~更多相关资讯,请关注网站更新。
2019年高考化学知识考点:元素周期表和元素周期律的应用
一、单项选择题
1.关于元素周期律和元素周期表的下列说法,正确的是( )。
A.目前的元素周期表已完善,不可能再有新元素被发现
B.元素的性质随原子序数的增加而呈周期性变化
C.化学家道尔顿为元素周期表的建立作出了巨大贡献
D.同一主族的元素从上到下,金属性逐渐减弱
2.有关元素周期表的叙述中不正确的是( )。
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀材料的元素
C.在金属元素区域可以寻找制备新型农药的元素
D.周期表中位置呈对角线的元素性质相似
3.下列说法正确的是( )。
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.X2+的核外电子数目为18,则X在第四周期第ⅡA族
4.下列各组原子序数所表示的两种元素,能形成AB2型化合物的是( )。
A.1和8 B.11和13
C.11和16 D.12和17
5.铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断正确的是( )。
A.Al的金属性强于Tl
B.能生成+3价的化合物
C.铊的氢氧化物的碱性比铝弱
D.Tl2O3与Al2O3都具有两性
6.元素R的最高价含氧酸的化学式为HnRO2n+2,则在气态氢化物中,R元素的化合价为( )。
A.4-3n B.3n-4
C.3n-10 D.6-3n
7.对下列粒子比较正确的是( )。
A.粒子半径:Cl->Cl
B.还原性:F->Cl-
C.粒子半径:Na+>Na
D.氧化性:Na+>Al3+
8.图1-2-1为周期表中的一部分,若a原子最外层电子数比次外层电子数少3个,则下列说法不正确的是( )。
图1-2-1
A.a、b、c最高价氧化物对应的水化物的酸性强弱关系是c>b>a
B.a、b、c的氢化物水溶液的酸性强弱关系是a
C.a和d的原子结合可以形成带3个单位负电荷的阴离子
D.原子半径由大到小的顺序是c>b>d>a
9.短周期金属元素甲~戊在周期表中的相对位置如右表所示,下面判断不正确的是( )。
A.原子半径:丙<丁<戊
B.金属性:甲<丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电...
你的考试准备的怎么样了,小编为你提供了2019年高考化学知识考点:元素的性质与原子结构,快来温习一下你的知识吧,希望能够帮助到你,更多相关资讯,请关注网站更新。
2019年高考化学知识考点:元素的性质与原子结构
一、单项选择题
1.下列原子中最易形成阴离子的是( )。
A.Cl B.F
C.Na D.K
2.化学上经常采用归类的方法研究一类物质。将Li、Na、K、Rb、Cs归为一类的根本原因是( )。
A.它们均为金属元素,都能形成相应的氧化物
B.五种元素的单质均为固体
C.它们原子的最外层电子数均为1个,在性质上具有相似性
D.它们形成的氢氧化物都是强碱
3.关于铯(Cs)及其化合物的性质,说法正确的是( )。
A.金属铯的熔点比金属钠高
B.CsOH比NaOH的碱性强
C.CsOH是一种弱碱
D.碳酸铯难溶于水
4.若用X代表F、Cl、Br、I四种卤族元素,下列属于共性反应的是(反应条件均省略)( )。
A.X2+H2===2HX
B.X2+H2O===HX+HXO
C.2Fe+3X2===2FeX3
D.X2+2NaOH===NaX+NaXO+H2O
5.下列各组微粒具有相同的质子数和电子数的是( )。
A.OH-、H2O B.NH3、NH4(+)
C.F-、NH4(+) D.HCl、F2
6.下列关于卤素的说法中,不正确的是( )。
A.单质的熔点和沸点随核电荷数的递增而逐渐升高
B.单质都有毒
C.单质的颜色随核电荷数递增依次加深
D.碘易溶于酒精,故利用酒精可将碘从碘水中萃取出来
7.各组性质比较的表示中,正确的是( )。
A.酸性:HI < HBr < HCl < HF
B.稳定性:HF< HCl < HBr < HI
C.氧化性:F2 < Cl2 < Br2 < I2
D.沸点:F2 < Cl2 < Br2 < I2
8.有三种金属元素a、b、c,在相同条件下,b的最高价氧化物对应水化物的碱性比a的最高价氧化物对应水化物的碱性强;a可以从c的盐溶液中置换出c。则这三种金属元素的金属性由强到弱的顺序是( )。
A.a、b、c B.b、a、c C.b、c、a D.c、b、a
9.下列关于碱金属和卤素的叙述中正确的是( )。
A.碱金属随着核电荷数增加,单质的密度逐渐减小
B.卤素随着核电荷数增加,单质的熔、沸点升高
C.碱金属随着核电荷数的增加,单质与水反应的剧烈程度增大
D.卤素随着核电荷数增加,单质的还原性逐渐减弱
10.碱金属钫(Fr)具有放射性,下列对其性质的预言中,错误的是( )。
A.在碱金属元素中它的原子核对最外层电子的引力最大
...
你的考试准备的怎么样啦,小编为你提供了2019年高考化学知识考点:核素,快来试试吧!希望能帮助到你考试哦。更多关于高考的内容,请关注网站更新。
2019年高考化学知识考点:核素
一、单项选择题
1.据最新报道, 67(166)Ho可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( )。
A.32 B.67 C.99 D.166
2.下列各组粒子属于同位素的是( )。
A.17(35)X和17(37)X B.19(40)K和20(40)Ca
C.O2和O3 D.H2O和D2O
3.碘131是碘元素的一种放射性核素。下列关于 53(131)I的说法正确的是( )。
A.质量数为131 B.质子数为78
C.核外电子数为78 D.中子数为53
4.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kur Wuethrich等人为此获得2002年度诺贝尔化学奖。下面有关13C、15N的叙述正确的是( )。
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
5.已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是( )。
A.a(b)R B. a-2(a+b-2)R
C. a+2(a+b+2)R D.a-2(a+b)R
6.下列关于2(3)He的说法正确的是( )。
A.2(3)He原子核内含有2个中子
B.2(3)He原子核内含有3个质子
C.2(3)He原子核外有3个电子
D.2(3)He和2(4)He是两种不同的核素
7.每年12月1日为世界艾滋病日,截至2010年10月底,我国累计报告艾滋病病毒感染者和病人37万余例。医学界通过放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病。关于14C的下列说法中正确的是( )。
A.14C与12C的质量比约为14∶12
B.14C原子与14N原子所含中子数相同
C.14C与C60都是碳元素的同位素
D.14C原子与C60中普通碳原子的化学性质不同
8.医学研究证明,用放射性 53(135)I治疗肿瘤可收到一定疗效,下列有关 53(135)I的叙述正确的是( )。
A. 53(135)I是碘的一种同素异形体
B. 53(135)I是一种新发现的元素
C. 53(135)I核内的中子数与核外电子数之差为29
D. 53(135)I位于元素周期表中第四周期第ⅦA族
9.下列说法正确的是( )。
A.氘和氚是质量数不同,质子数相同的氢的两种核素
B.氢元素是指1(1)H
C.1(1)H、1(2)H、1(3)H是氢的三种核素,是同一元素的...
你的考试准备的怎么样了,小编为你提供了2019年高考化学知识考点:共价键,希望能增进你的化学知识,想要更多相关化学知识,请关注网站更新。
2019年高考化学知识考点:共价键
一、单项选择题
1.下列化合物中,既有离子键又有共价键的是( )。
A.NH4Cl B.MgO
C.CH4 D.CO2
2.下列电子式中,正确的是( )。
A.Cl∶Cl B.∶N??N∶
C.H+[∶·· ∶]- D.Na∶·· ∶
3.下列各组指定原子序数的元素,能形成AB3型共价化合物的是( )。
A.6和8 B.16和8 C.12和9 D.11和6
4.下列分子中,所有原子的最外层均为8电子结构的是( )。
A.BeCl2 B.H2S C.NCl3 D.SF6
5.下列说法正确的是( )。
A.共价化合物中一定不含离子键
B.离子化合物中一定不含共价键
C.任何化学物质中均存在化学键
D.全部由非金属元素形成的化合物一定是共价化合物
6.下列说法不正确的是( )。
A.范德华力是分子间作用力
B.分子间氢键的形成除使物质的熔、沸点升高外,对物质的溶解度、硬度等也都有影响
C.分子间作用力与氢键可同时存在于分子之间
D.氢键是一种特殊的化学键,它广泛存在于分子之间
7.下列物质中,含有极性共价键的是( )。
A.单质碘 B.氯化镁
C.溴化钾 D.水
8.下列分子含有的电子数目与HF相同,且只有两个极性共价键的是( )。
A.CO2 B.N2O C.H2O D.CH4
9.下列说法正确的是( )。
A.同种元素组成的单质中一定存在共价键
B.非金属元素的气态氢化物中一定存在共价键
C.离子化合物中一定含有离子键
D.在一种化合物中只能存在一种类型的化学键
10.1999年曾报导合成和分离了含高能量的正离子N5(+)的化合物N5AsF6,下列叙述错误的是( )。
A.N5(+)共有24个核外电子
B.N5(+)中N—N原子间以共用电子对结合
C.化合物N5AsF6中As化合价为+l价
D.化合物N5AsF6中F化合价为-1价
三、非选择题
11.有下列7种物质:A.干冰、B.氧化镁、C.氯化铵、D.固态碘、E.烧碱、F.冰、G.小苏打。
(1)受热时需要破坏共价键的是________(填字母,下同)。
(2)熔点最低的是________。
(3)既有离子键又有共价键的是________。
(4)只含有极性键的是________。
(5)含非极性键的是________。
12.下列化合物中,同时含有离子键、极性共价键和非极性共价键的是( )。
<...11-12
高考频道为大家提供天水一中2019届一轮复习第三次质量检测化学试题,一起来了解一下吧!更多高考资讯请关注我们网站的更新!
天水一中2019届一轮复习第三次质量检测化学试题



小编精心为您推荐:
高考化学试题推荐访问